正常な免疫系は、病原微生物などに反応し、これを排除するが、正常な自己組織には反応しない。もしリンパ球が正常な自己抗原に反応し組織を破壊すれば、関節リウマチ、若年性糖尿病などの自己免疫病となる。この自己に対する免疫不応答、即ち、免疫自己寛容が、正常個体でどのように確立され、どのように維持されるか、の理解は、自己免疫病の原因・発症機構の理解とその治療・予防に留まらない。自己組織から発生した癌細胞に対する効果的な免疫応答の惹起法、さらには、他人からの移植臓器をあたかも自己組織として安定に受容させる方法の開発に繋がる。また、花粉など生体に無害な物質に対する過剰反応であるアレルギーの制御に繋がる。
当研究室では、このような免疫自己寛容の重要な機序として、正常個体中に存在し、自己と反応するリンパ球の活性化・増殖を抑制する内在性制御性T細胞を発見し、研究している。抑制機能をもつT細胞が存在するか否かについては免疫学者の間で長年にわたり議論があった。私たちは、それが機能的、発生的に特異なT細胞群であり、その異常は免疫自己寛容を破綻させ、自己免疫病の原因となることを実験的に証明した。また、この内在性制御性T細胞の減少、機能の減弱によって有効な腫瘍免疫を誘導でき、逆に、制御性T細胞を強化すれば移植臓器に対する安定な免疫寛容が誘導可能であることを実験的に示した。さらに、自己免疫病、アレルギー、炎症性腸疾患を伴うヒトの遺伝性免疫疾患のひとつが、内在性制御性T細胞の発生・機能のマスター制御遺伝子Foxp3の異常によることを証明し、制御性T細胞の異常がヒトの免疫疾患の直接的原因となる可能性を明確に示した。同時に、この細胞群の発生・機能を細胞、遺伝子レベルで操作し、自己免疫病、アレルギーなどの免疫疾患の治療に応用できる可能性を開いた。制御性T細胞の研究は、ここ数年、自己免疫疾患、アレルギー、慢性感染症、臓器移植、癌免疫などの病的、生理的免疫応答の制御を目指して、世界中で活発、急速な進展をみせている。制御性T細胞の広汎な医療応用を目指して活発な研究を展開したいと考えている。
当研究室のもうひとつの研究テーマは、自己免疫病、特に関節リウマチの研究である。私たちの樹立したSKGマウスは、ヒトの関節リウマチと酷似した自己免疫性関節炎を自然発症する。その原因は、T細胞シグナル分子ZAP70の一塩基突然変異であり、その結果、胸腺でのT細胞選択機構が変化し、関節炎惹起性T細胞が産生される。このようなシグナル伝達の遺伝子異常が、どのようにして特定の自己免疫病を発症させるに到るかを解明したいと考えている。
いずれの研究テーマも、基礎的には、免疫寛容の分子、細胞機構の解明、応用としては、生理的、病的免疫応答の制御法の開発が目的である。
1. 制御性T細胞の発生をコントロールする分子メカニズム
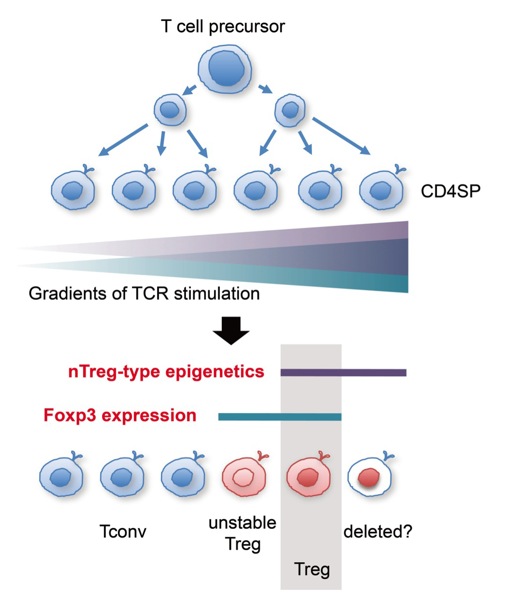
現在、Foxp3+ T細胞を制御性T(Treg)細胞として定義する考え方が一般に普及している。しかし正確には、Foxp3発現細胞はTreg細胞と完全には一致しない。Treg細胞系譜(cell lineage)を決定する要素は、タンパク質発現の有無ではなく、遺伝形質としての非ゲノム情報、すなわちエピゲノムの再構成にある。現在までに、我々は全ゲノムにわたるTreg細胞のDNAメチル化パターン解析をヒト、マウスにおいて終了している。さらにこのTreg特異的DNAメチル化パターン形成はFoxp3発現誘導とは独立の事象として成立し、Treg機能発現、全遺伝子発現パターンの形成、Tregの維持安定に必須な要素であることも明らかにした。これらのことは、Tregの発生には、2つの独立した要素、すなわちFoxp3誘導とTreg型エピゲノム形成が必要であり、さらに自己免疫疾患治療を見据えたTreg誘導においては、従来のFoxp3誘導を中心とした考え方では不十分であり、Treg型エピゲノム誘導による完全な分化誘導こそが必須条件であることを示している。現在、Tregのエピゲノム情報の完全な解析、誘導要素の同定、およびTreg型エピゲノム形成に関わる分子メカニズムの解明をめざして研究を行っている。Treg型エピゲノムの効率的誘導は、自己免疫疾患に対する真の治療法となる可能性を秘めている。